MurciaSalud
COVID-19
¿Tienen mayor riesgo de infección las mujeres gestantes? Última actualización: . Revisión de la literatura:
No hay evidencia que sugiera que las mujeres embarazadas tienen más probabilidades de contraer la infección en comparación con la población general (es decir, el embarazo no parece aumentar la susceptibilidad a la infección) (1,2).
Bibliografía
- BMJ Best Practice: Management of coexisting conditions in the context of COVID-19. Last updated: May 26, 2021 (Consultado el 02 junio 2021) (Ver documento)
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 02 junio de 2021) (Ver documento)
¿Tienen mayor riesgo de infección grave las mujeres gestantes? Última actualización: . Revisión de la literatura:
Los datos disponibles sugieren que el embarazo es una situación de mayor riesgo de complicaciones del curso clínico de la COVID-19, y que la COVID-19 también constituye un mayor riesgo para el propio curso del embarazo (1,2).
En la actualización de febrero de 2021 de la guía sobre embarazo y COVID-19 del "Royal College of Obstetricians and Gynaecologists" (3) se destacan como puntos clave :
- Más de dos tercios de las mujeres embarazadas con COVID-19 son asintomáticas.
- En comparación con las mujeres no embarazadas con COVID-19, las mujeres embarazadas con COVID-19 tienen tasas más altas de ingreso a la unidad de cuidados intensivos (UCI) aunque no un mayor riesgo de muerte por COVID-19
- En comparación con las mujeres embarazadas sin COVID-19, las mujeres embarazadas con COVID-19 sintomático que requieren hospitalización tienen, en general, peores resultados maternos, incluido un mayor riesgo de muerte, aunque ese riesgo sigue siendo muy bajo (la tasa de mortalidad materna del Reino Unido por COVID-19 es de 2,2 por 100 000 maternidades).
Aunque el riesgo absoluto de complicaciones graves en el embarazo se calcula bajo, en relación con el conjunto de la población, un análisis de los CDC (4) (cuya información incorpora el informe del "American College of Obstetricians and Gynecologists" (5)) sugiere que entre las mujeres sintomáticas con COVID-19, las mujeres embarazadas (n = 23.434 ) muestran tener un mayor riesgo de ciertas manifestaciones de enfermedad grave en comparación con las mujeres sintomáticas con COVID-19 no embarazadas (n = 386,028).
En comparación con las mujeres no embarazadas, las mujeres embarazadas fueron ingresadas en una UCI con mayor frecuencia (10,5 versus 3,9 por 1000 casos; riesgo relativo ajustados [RRa] = 3,0; intervalo de confianza [IC] del 95% = 2,6¿3,4), y precisaron con mayor frecuencia ventilación invasiva (2,9 versus 1,1 por 1000 casos; RRa = 2,9; IC del 95% = 2,2-3,8) y recibió ECMO (0,7 versus 0,3 por 1000 casos; RRa = 2,4; IC del 95% = 1,5-4,0). Se notificaron 34 muertes (1,5 por 1.000 casos) entre las mujeres embarazadas sintomáticas y 447 (1,2 por 1.000 casos) entre las mujeres no embarazadas, lo que refleja un aumento del 70% en el riesgo de muerte asociado con el embarazo (RRa = 1,7; IC del 95% = 1,2-2,4). Independientemente del estado de embarazo, los ingresos a la UCI, la necesidad de ventilación invasiva y la muerte ocurrieron con más frecuencia entre las mujeres de 35 a 44 años que entre las de 15 a 24 años.
La edad materna elevada, la etnia no blanca, y la presencia de comorbilidades, como obesidad, diabetes gestacional o preeclampsia, se relacionan con una enfermedad COVID-19 más grave durante el embarazo.
La presencia de comorbilidad materna también se asocia a mayor mortalidad: un metanálisis (6), que incluyó 13 estudios con 154 gestantes fallecidas, observa que, en general, la presencia de una comorbilidad o un factor de riesgo aumentó el riesgo de muerte al doble durante la infección por COVID-19 (RR 2,26; IC del 95%: 1,77 a 2,89). La presencia de obesidad en la gestante duplicó el riesgo de muerte (RR 2,48; IC del 95%: 1,41-4,36) pero no hubo cambios significativos en el riesgo de muerte en mujeres con diabetes gestacional o asma. Además, la necesidad de ingreso en UCI se asoció con un riesgo de muerte cinco veces mayor (RR 5,09; IC del 95%: 2,00-12,98).
En relación a este aspecto una revisión sistemática "viva" ("Living systematic review") (7), publicada en septiembre de 2020 en el BMJ, incluyó 77 estudios de cohortes, con un total 11.432 mujeres embarazadas.
- El 10% (IC 95% del 7% al 14%) de las mujeres embarazadas que ingresaron o fueron atendidas en el hospital por cualquier motivo, fueron diagnosticadas de COVID-19, como caso confirmado o sospechoso.
- El riesgo de complicaciones graves en las gestantes con COVID-19 confirmado o sospechoso fue del 13% (IC 95% del 6% al 21%).
- Las gestantes con COVID-19 tenían más probabilidades de necesitar ingreso en una UCI (odds ratio [OR] de 1,62;IC 95% 1,33 a 1,96;) y ventilación invasiva (OR 1,88; IC 95% 1,36 a 2,60) que las no gestantes.
- Los factores de riesgo asociados a un curso grave de la enfermedad según este estudio fueron: la mayor edad (¿35 años), el mayor índice de masa corporal, la hipertensión crónica, la diabetes preexistente y la pre-eclampsia.
- La comorbilidad materna preexistente fue un factor de riesgo para el ingreso en una UCI (4,21;IC al 95% de 1,06 a 16,72; y para la ventilación invasiva (OR de 4,48; IC de 1,40 a 14,37).
- 73 mujeres embarazadas (0,1%) con COVID-19 confirmado, fallecieron (mortalidad total, por cualquier causa).
Y otra amplia revisión sistemática (8) (31.016 mujeres embarazadas) se informa que: las mujeres tenían un promedio de 30,9 años de edad; la mayoría (77,7%) estaban en el tercer trimestre y el 16,4% desarrollaron COVID-19 grave. Casi la mitad eran asintomáticos, mientras que los síntomas más comunes fueron tos, fiebre, fatiga y anosmia / ageusia. Aproximadamente el 7% ingresó en la UCI, el 8% requirió ventilación mecánica y el 2% de las mujeres falleció. El 48,4% de las mujeres que dieron a luz tuvo partos por cesárea. Entre los recién nacidos, el 23,4% eran prematuros (<37 semanas), el 16,6% tenían bajo peso al nacer y el 23,7% ingresaron en la UCI neonatal. Se registró un total de 21 mortinatos (1,6%) y 24 muertes neonatales (1,6%), mientras que 50 bebés (3,5%) fueron COVID-19 positivos. Los estudios que compararon mujeres embarazadas con COVID-19 grave y no grave mostraron que las mujeres con COVID-19 grave tenían 3,7 años más y el riesgo de COVID-19 grave era 1,5 veces mayor entre las mujeres> 35 años. El riesgo de COVID-19 grave fue significativamente mayor entre las mujeres obesas, fumadoras, diabéticas y con preeclampsia. El riesgo de parto prematuro fue de casi 2,4 veces entre las mujeres con COVID-19 grave.
Por otra parte, un metanálisis publicado en junio de 2021 (9) identifica, entre otros aspectos, un aumento significativo en la mortalidad materna durante la pandemia en comparación con antes de la pandemia: OR combinado 1,37 (IC 95% 1,22 - 1,53; 1.237.018 y 2.224.859 embarazos durante y antes de la pandemia).
Bibliografía
- Información científico-técnica: Enfermedad por coronavirus, COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Ministerio de Sanidad. Actualización, 15 de enero 2021.(Ver documento)
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio de 2021) (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- Zambrano LD, Ellington S, Strid P, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status ¿ United States, January 22¿October 3, 2020. MMWR Morb Mortal Wkly Rep 2020;69:1641¿1647. (Ver documento)
- Practice Advisory: Novel coronavirus 2019 (COVID-19). American College of Obstetricians and Gynecologists (ACOG). Last updated July 8, 2021. (Ver documento)
- La Verde M, Riemma G, Torella M, Cianci S, Savoia F, Licciardi F, Scida S, Morlando M, Colacurci N, De Franciscis P. Maternal death related to COVID-19: A systematic review and meta-analysis focused on maternal co-morbidities and clinical characteristics. Int J Gynaecol Obstet. 2021 Apr 30. (Ver documento)
- Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, Debenham L, Llavall AC, Dixit A, Zhou D, Balaji R, Lee SI, Qiu X, Yuan M, Coomar D, van Wely M, van Leeuwen E, Kostova E, Kunst H, Khalil A, Tiberi S, Brizuela V, Broutet N, Kara E, Kim CR, Thorson A, Oladapo OT, Mofenson L, Zamora J, Thangaratinam S; for PregCOV-19 Living Systematic Review Consortium. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020 Sep 1;370:m3320. (Ver documento)
- Lassi ZS, Ana A, Das JK, Salam RA, Padhani ZA, Irfan O, Bhutta ZA. A systematic review and meta-analysis of data on pregnant women with confirmed COVID-19: Clinical presentation, and pregnancy and perinatal outcomes based on COVID-19 severity. J Glob Health. 2021 Jun 30;11:05018. (Ver documento)
- Chmielewska B, Barratt I, Townsend R, Kalafat E, van der Meulen J, Gurol-Urganci I, O'Brien P, Morris E, Draycott T, Thangaratinam S, Le Doare K, Ladhani S, von Dadelszen P, Magee L, Khalil A. Effects of the COVID-19 pandemic on maternal and perinatal outcomes: a systematic review and meta-analysis. Lancet Glob Health. 2021 Jun;9(6):e759-e772. (Ver documento)
Las gestantes con COVID-19,¿tienen mayor riesgo de resultados adversos obstétricos y/ neonatales? Última actualización: . Revisión de la literatura:
Actualmente no hay datos que sugieran un mayor riesgo de aborto espontáneo o pérdida temprana del embarazo en relación a la infección por SARS-CoV-2 pero los datos de infecciones en el primer y segundo trimestre son limitados (1). Tampoco se ha evidenciado un aumento de las malformaciones congénitas (2).
Sin embargo, algunas series publicadas describen una mayor incidencia de complicaciones durante el embarazo o el parto en mujeres afectadas por COVID 19, fundamentalmente en casos de enfermedad grave (3,4): el COVID-19 materno se relaciona con un riesgo más alto de preeclampsia, parto prematuro, tromboembolismo venoso e infarto de miocardio. La gravedad de la enfermedad se asocia con tasas más altas de parto prematuro, parto por cesárea, ingreso en cuidados intensivos maternos, ingreso en cuidados intensivos neonatales y muerte materna.
En un estudio prospectivo realizado en 45 hospitales en España (5), entre los 1.009 embarazos evaluados, 246 fueron positivos para SARS-CoV-2 (en el momento del ingreso en la sala de partos, se realizó a todas las mujeres una RT-PCR para COVID-19). De los 246 casos positivos, el 88,6% (n = 218) estaban asintomáticos al momento del parto, mientras que el 11,4% (n = 28) eran sintomáticos. En comparación con las madres negativas (763 casos), la infección por SARS-CoV-2 aumentó la probabilidad de:
- parto prematuro: 13,8% frente a 6,7%, (OR ajustada de 2,12, IC del 95%: 1,32-3,36, p = 0,002). El parto prematuro iatrogénico fue más frecuente en mujeres infectadas (4,9% vs 1,3%, p = 0,001); la ocurrencia de partos prematuros espontáneos fue estadísticamente similar (6,1% vs 4,7%).
- riesgo de rotura prematura de membranas a término:15,8% vs 9,8% (ORa de 1,70, IC 95% 1,11-2,57, p = 0,013)
- ingreso en la unidad de cuidados intensivos neonatales: 9,3% vs 2,4 % ( ORa de 4,62, IC 95% 2,43¿8,94, p <0,001).
En cuanto a los resultados neonatales, más del 95% de los recién nacidos de madres positivas al SARS-CoV-2 presentan buen estado general al nacer (2,4). La morbilidad neonatal (por ejemplo, necesidad de ventilación mecánica) se ha relacionado en gran medida con el parto prematuro y con los entornos uterinos adversos resultantes del COVID-19 materno crítico (1).
De recientes estudios observacionales destacamos los siguientes datos:
Un estudio de cohortes multinacional (participaron 43 instituciones de 18 países) fue realizado con el objetivo de evaluar los riesgos asociados con COVID-19 en el embarazo sobre los resultados maternos y neonatales en comparación con las mujeres embarazadas no infectadas (6). Se inscribieron un total de 706 mujeres embarazadas con diagnóstico de COVID-19 y 1.424 mujeres embarazadas sin diagnóstico de COVID-19, todas con características demográficas muy similares (edad media 30,2 [6,1] años). Las mujeres con diagnóstico de COVID-19 tenían un mayor riesgo de preeclampsia / eclampsia (riesgo relativo [RR] 1,76; IC del 95%, 1,27-2,43), infecciones graves (RR 3,38; IC del 95%, 1,63-7,01), ingreso en UCI (RR 5,04; IC del 95%, 3,13-8,10), mortalidad materna (RR 22,3; IC del 95%, 2,88-172), parto prematuro espontáneo (RR 1,59; IC del 95%, 1,30-1,94), parto prematuro médicamente indicado (RR 1,97; IC del 95%, 1,56-2,51), morbilidad neonatal grave (RR 2,66; IC del 95%, 1,69-4,18) y mortalidad y morbilidad perinatal grave (RR 2,14; IC del 95%, 1,66-2,75).Las mujeres asintomáticas con diagnóstico de COVID-19 presentaron mayor riesgo de morbilidad materna (RR 1,24; IC del 95%, 1,00-1,54) y preeclampsia (RR 1,63; IC del 95%, 1,01-2,63). Entre las mujeres que dieron positivo (98,1% por RT-PCR), 54 (13%) de sus recién nacidos dieron positivo. El parto por cesárea (RR 2,15; IC del 95%, 1,18-3,91) pero no la lactancia materna (RR 1,10; IC del 95%, 0,66-1,85) se asoció con un mayor riesgo de positividad en la prueba neonatal.
En otro amplio estudio de cohortes prospectivo (7), que incluyó a 88.159 bebés de Suecia, la infección por SARS-CoV-2 en el embarazo se asoció significativamente con una mayor morbilidad neonatal pero no con mayor mortalidad. Del total de bebés evaluados 2.323 (1,6%) nacieron de madres que dieron positivo al SARS-CoV-2. La proporción de lactantes prematuros (edad gestacional <37 semanas) fue de 205 / 2.323 (8,8%) entre los lactantes de madres positivas al SRAS-CoV-2 y de 4.719/85.836 (5,5%) entre los lactantes control. Después de emparejar las características maternas, la positividad de la prueba del SARS-CoV-2 materno se asoció significativamente con el ingreso en atención neonatal (11,7% frente a 8,4%; razón de posibilidades [OR] 1,47; IC del 95% 1,26-1,70) y con morbilidades neonatales tales como síndrome de dificultad respiratoria (1,2% frente a 0,5%; OR 2,40; IC del 95% 1,50-3,84), cualquier trastorno respiratorio neonatal (2,8% frente al 2,0%; OR 1,42; IC del 95% 1,07-1,90) e hiperbilirrubinemia (3,6% frente a 2,5%; OR 1,47; IC del 95% 1,13-1,90). La mortalidad (0,30% frente a 0,12%; OR 2,55; IC del 95%, 0,99-6,57), las tasas de lactancia materna al alta (94,4% frente al 95,1%; OR 0,84; IC del 95% 0,67-1,05) y la duración de la estancia en la unidad neonatal (mediana 6 días en ambos grupos; diferencia, 0 días; IC del 95%, -2 a 7 días) no difirió significativamente entre los grupos. Veintiún bebés (0,90%) de madres positivas para el SARS-CoV-2 dieron positivo al SARS-CoV-2 en el período neonatal; 12 no tenían morbilidad neonatal, 9 tenían diagnósticos con una relación poco clara con el SARS-CoV-2 y ninguno tenía neumonía congénita.
Y una amplia revisión sistemática (8) (31.016 mujeres embarazadas) informa que: las mujeres tenían un promedio de 30,9 años de edad; la mayoría (77,7%) estaban en el tercer trimestre y el 16,4% desarrollaron COVID-19 grave. Aproximadamente el 7% ingresó en la UCI, el 8% requirió ventilación mecánica y el 2% de las mujeres falleció. El 48,4% de las mujeres que dieron a luz tuvo partos por cesárea. Entre los recién nacidos, el 23,4% eran prematuros (<37 semanas), el 16,6% tenían bajo peso al nacer y el 23,7% ingresaron en la UCI neonatal. Se registró un total de 21 mortinatos (1,6%) y 24 muertes neonatales (1,6%), mientras que 50 bebés (3,5%) fueron COVID-19 positivos.
Un metanálisis publicado en junio de 2021 (9) identifica un aumento significativo en la mortalidad materna, muerte fetal intrauterina, rotura de embarazos ectópicos rotos y síntomas maternos de depresión, durante la pandemia en comparación con antes de la pandemia.
En cuanto a la afectación mental de las gestantes durante la pandemia, otro metanálisis de junio de 2021 (15 estudios con un total de 11.187 embarazadas/parturientas) (10) encuentra que la prevalencia de depresión fue del 30% (IC del 95%: 0,23-0,37), la prevalencia de ansiedad fue del 34% (IC del 95%: 0,26-0,43) y la prevalencia tanto de ansiedad como de depresión fue del 18% (95% CI: 0,09-0,29). Las prevalencias de ansiedad (OR = 2,15, IC del 95%: 1,39-3,31) y depresión (OR = 1,95, IC del 95%: 1,07-3,56) fueron más altas que la de los controles.
Bibliografía
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- BMJ Best Practice: Management of coexisting conditions in the context of COVID-19. Last updated: Jul 01, 2021 (Consultado el 12 julio 2021) (Ver documento)
- Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, Debenham L, Llavall AC, Dixit A, Zhou D, Balaji R, Lee SI, Qiu X, Yuan M, Coomar D, van Wely M, van Leeuwen E, Kostova E, Kunst H, Khalil A, Tiberi S, Brizuela V, Broutet N, Kara E, Kim CR, Thorson A, Oladapo OT, Mofenson L, Zamora J, Thangaratinam S; for PregCOV-19 Living Systematic Review Consortium. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020 Sep 1;370:m3320. (Ver documento)
- Martinez-Perez O, Prats Rodriguez P, Muner Hernandez M, Encinas Pardilla MB, Perez Perez N, Vila Hernandez MR, et al; Spanish Obstetric Emergency Group. The association between SARS-CoV-2 infection and preterm delivery: a prospective study with a multivariable analysis. BMC Pregnancy Childbirth. 2021 Apr 1;21(1):273. (Ver documento)
- Villar J, Ariff S, Gunier RB, Thiruvengadam R, Rauch S, Kholin A, Roggero P, Prefumo F, do Vale MS, Cardona-Perez JA, Maiz N, Cetin I, Savasi V, Deruelle P, Easter SR, Sichitiu J, Soto Conti CP, Ernawati E, Mhatre M, Teji JS, Liu B, Capelli C, Oberto M, Salazar L, Gravett MG, Cavoretto PI, Nachinab VB, Galadanci H, Oros D, Ayede AI, Sentilhes L, Bako B, Savorani M, Cena H, García-May PK, Etuk S, Casale R, Abd-Elsalam S, Ikenoue S, Aminu MB, Vecciarelli C, Duro EA, Usman MA, John-Akinola Y, Nieto R, Ferrazi E, Bhutta ZA, Langer A, Kennedy SH, Papageorghiou AT. Maternal and Neonatal Morbidity and Mortality Among Pregnant Women With and Without COVID-19 Infection: The INTERCOVID Multinational Cohort Study. JAMA Pediatr. 2021 Apr 22. (Ver documento)
- Norman M, Navér L, Söderling J, Ahlberg M, Hervius Askling H, Aronsson B, Byström E, Jonsson J, Sengpiel V, Ludvigsson JF, Håkansson S, Stephansson O. Association of Maternal SARS-CoV-2 Infection in Pregnancy With Neonatal Outcomes. JAMA. 2021 Apr 29. (Ver documento)
- Lassi ZS, Ana A, Das JK, Salam RA, Padhani ZA, Irfan O, Bhutta ZA. A systematic review and meta-analysis of data on pregnant women with confirmed COVID-19: Clinical presentation, and pregnancy and perinatal outcomes based on COVID-19 severity. J Glob Health. 2021 Jun 30;11:05018. (Ver documento)
- Chmielewska B, Barratt I, Townsend R, Kalafat E, van der Meulen J, Gurol-Urganci I, O'Brien P, Morris E, Draycott T, Thangaratinam S, Le Doare K, Ladhani S, von Dadelszen P, Magee L, Khalil A. Effects of the COVID-19 pandemic on maternal and perinatal outcomes: a systematic review and meta-analysis. Lancet Glob Health. 2021 Jun;9(6):e759-e772. (Ver documento)
- Sun F, Zhu J, Tao H, Ma Y, Jin W. A systematic review involving 11,187 participants evaluating the impact of COVID-19 on anxiety and depression in pregnant women. J Psychosom Obstet Gynaecol. 2021 Jun;42(2):91-99. (Ver documento)
En gestantes con COVID-19, ¿cuáles son los hallazgos clínicos más frecuentes? Última actualización: . Revisión de la literatura:
Un análisis de los CDC (1) informa que, entre todas las mujeres evaluadas, la tos, el dolor de cabeza, los dolores musculares y la fiebre fueron los signos y síntomas notificados con mayor frecuencia; la mayoría de los síntomas fueron comunicados con menos frecuencia por mujeres embarazadas que por mujeres no embarazadas (tos: 50,3% vs 51,3%); dolor de cabeza 42,7% vs 54,9%; dolores musculares 36,7% vs 45,2%; fiebre 32,0% vs 39,3%; dolor de garganta 28,4%vs 34,6%; dificultad para respirar 25,9% vs 24,8%; nueva pérdida del gusto u olfato 21,5% vs 24,8%).Otros síntomas que ocurrieron en > 10% de cada grupo incluyeron náuseas, vómitos, fatiga, diarrea y rinorrea.
Muchas mujeres embarazadas con COVID-19 son asintomáticas, pero la proporción de casos asintomáticos no está bien definida(2): en dos revisiones sistemáticas (3,4) se describe una tasa de mujeres embarazadas con COVID-19 asintomático del 75% y del 95%, respectivamente.
Bibliografía
- Zambrano LD, Ellington S, Strid P, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status ¿ United States, January 22¿October 3, 2020. MMWR Morb Mortal Wkly Rep 2020;69:1641¿1647. (Ver documento)
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, Debenham L, Llavall AC, Dixit A, Zhou D, Balaji R, Lee SI, Qiu X, Yuan M, Coomar D, van Wely M, van Leeuwen E, Kostova E, Kunst H, Khalil A, Tiberi S, Brizuela V, Broutet N, Kara E, Kim CR, Thorson A, Oladapo OT, Mofenson L, Zamora J, Thangaratinam S; for PregCOV-19 Living Systematic Review Consortium. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020 Sep 1;370:m3320. (Ver documento)
- Yanes-Lane M, Winters N, Fregonese F, Bastos M, Perlman-Arrow S, Campbell JR, Menzies D. Proportion of asymptomatic infection among COVID-19 positive persons and their transmission potential: A systematic review and meta-analysis. PLoS One. 2020 Nov 3;15(11):e0241536.(Ver documento)
En gestantes con COVID-19, ¿cuáles son los hallazgos más frecuentes en las pruebas de laboratorio e imagen? Última actualización: . Revisión de la literatura:
Los hallazgos de laboratorio y de las pruebas de imagen son generalmente similares a los de las personas no embarazadas (1):
En una revisión sistemática, los hallazgos de laboratorio que presentaron las mujeres incluyeron (2): elevación de la proteína C reactiva (49%9, linfopenia (35%), leucocitosis (27%), nivel elevado de procalcitonina (21%), enzimas hepáticas anormales (11 %), o trombocitopenia (8%)
En otras revisión sistemática de 427 pacientes embarazadas diagnosticadas con COVID-19 (3), los hallazgos pulmonares encontrados con mayor frecuencia en la tomografía computarizada de tórax fueron opacidades en vidrio deslustrado (77%), afectación pulmonar posterior (73%), afectación multilobar (72%), afectación pulmonar bilateral (69%), distribución periférica (68%) y consolidación (41%).
Bibliografía
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S, Kew T, Debenham L, Llavall AC, Dixit A, Zhou D, Balaji R, Lee SI, Qiu X, Yuan M, Coomar D, van Wely M, van Leeuwen E, Kostova E, Kunst H, Khalil A, Tiberi S, Brizuela V, Broutet N, Kara E, Kim CR, Thorson A, Oladapo OT, Mofenson L, Zamora J, Thangaratinam S; for PregCOV-19 Living Systematic Review Consortium. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020 Sep 1;370:m3320. (Ver documento)
- Oshay RR, Chen MYC, Fields BKK, Demirjian NL, Lee RS, Mosallaei D, Gholamrezanezhad A. COVID-19 in pregnancy: a systematic review of chest CT findings and associated clinical features in 427 patients. Clin Imaging. 2021 Jul;75:75-82. (Ver documento)
¿Hay evidencia de transmisión vertical de la infección? Última actualización: . Revisión de la literatura:
La transmisión vertical intrauterina SARS-CoV-2 ha sido definida como la determinación en el recién nacido de una prueba positiva de SARS-CoV-2 en placenta, líquido amniótico, sangre del cordón umbilical o hisopos nasofaríngeos y/o orofaríngeos del recién nacido a través de RT-PCR realizada inmediatamente después del nacimiento (1).
Aunque es posible la transmisión vertical del SARS-CoV-2, los datos actuales sugieren que es poco común (2)
La transmisión de la infección de la madre al neonato se produciría fundamentalmente tras el nacimiento por el contacto del bebé con las secreciones respiratorias de la madre (1,3); sin embargo, datos recientes sugieren que la transmisión vertical sería posible al hallarse anticuerpos Ig M en recién nacidos que han permanecido apartados de sus madres después del nacimiento. Continúa sin estar claro el grado de transmisión vertical del SARS-CoV-2 y el momento en que se produce (4).
En una revisión sistemática (5) se incluyeron 38 estudios observacionales con un total de 936 neonatos evaluados. La síntesis cuantitativa reveló que de los 936 recién nacidos de madres con COVID-19 confirmada, 27 recién nacidos tuvieron un resultado positivo para la prueba de ARN viral del SARS-CoV-2 utilizando hisopo nasofaríngeo, lo que indica una proporción combinada del 3,2% (IC 95% 2,2- 4,3) para transmisión vertical. Concluyen los autores que la transmisión vertical de la infección por SARS-CoV-2 es posible y parece ocurrir en una minoría de casos de infección materna en el tercer trimestre. Como limitación plantean que, dada la escasez de datos de mujeres con infección durante el primer trimestre, aún no se puede realizar una evaluación con respecto a las tasas de transmisión vertical al principio del embarazo y el riesgo potencial de morbilidad y mortalidad fetal consiguiente.
En otra revisión sistemática (en este caso una revisión sistemática viva) (6) se evaluaron 33 estudios con un total de 205 bebés nacidos de madres positivas a COVID-19. De forma global, el 6,3% (13/205; IC del 95%: 3,0% -9,7%) de los bebés dieron positivo al virus COVID-19 al nacer. Hubo 6 estudios que informaron sobre inmunoglobulinas G / M (IgG / IgM) contra el SARS-CoV-2 entre los bebés nacidos de madres positivas al virus COVID-19. Los anticuerpos se cuantificaron en 11 bebés, de los cuales 10 bebés (90,9%; IC del 95%: 73,9% -107,9%) tenían IgG / IgM contra el SARS-CoV-2. Entre los 10 bebés con anticuerpos detectados contra el SARS-CoV-2, solo un bebé (10%; -8,6% -28,6%) dio positivo al virus COVID-19. Se concluye en el documento que la evidencia actual revela que existe una baja posibilidad de transmisión vertical en bebés nacidos de madres positivas al virus COVID-19. Resalta además, que se detectaron anticuerpos contra el SARS-CoV-2 entre los bebés que dieron negativo al COVID-19 y que se necesitan más estudios sobre la transmisión transplacentaria y la magnitud de la inmunidad pasiva natural en bebés nacidos de madres con COVID-19.
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Available at https://www.covid19treatmentguidelines.nih.gov/. (Consultado el 12 julio 2021). (Ver documento)
- Información científico-técnica: Enfermedad por coronavirus, COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Ministerio de Sanidad. Actualización, 15 de enero 2021. (Ver documento)
- World Health Organization. Definition and categorization of the timing of mother-to-child transmission of SARS-CoV-2: scientific brief. 2021 [internet publication].(Ver documento)
- Kotlyar AM, Grechukhina O, Chen A, Popkhadze S, Grimshaw A, Tal O, Taylor HS, Tal R. Vertical transmission of coronavirus disease 2019: a systematic review and meta-analysis. Am J Obstet Gynecol. 2021 Jan;224(1):35-53.e3. (Ver documento)
- Bwire GM, Njiro BJ, Mwakawanga DL, Sabas D, Sunguya BF. Possible vertical transmission and antibodies against SARS-CoV-2 among infants born to mothers with COVID-19: A living systematic review. J Med Virol. 2020 Oct 22. (Ver documento)
Corticoides para maduración pulmonar. Última actualización: . Revisión de la literatura:
Los corticosteroides prenatales son beneficiosos en caso de amenaza de parto prematuro o si se prevé un parto prematuro iatrogénico. No hay evidencia de que los corticosteroides en las dosis prescritas para la maduración pulmonar fetal causen algún daño en el contexto de COVID-19, pero tampoco hay evidencia de seguridad. El efecto desconocido sobre el resultado materno debería sopesarse con el beneficio neonatal, particularmente en las gestaciones prematuras tardías (1-3).
En nuestro entorno, en mujeres con riesgo de parto prematuro se propone utilizar corticoides para la maduración pulmonar fetal, siempre de acuerdo con el equipo multidisciplinar que atiende a la paciente embarazada (4):
- 24 - 33 + 6 semanas de gestación, se recomienda ofrecer tratamiento con corticoides
- 34 - 35 + 6 semanas de gestación, se considerará el tratamiento con corticoides ya que, hasta el momento, no hay evidencia en los brotes de COVID-19, SARS o MERS de que un tratamiento de esteroides para la maduración pulmonar fetal cause algún efecto adverso clínicamente significativo sobre la enfermedad de la madre.
Como tratamiento para la infección se recomienda el uso de dexametasona: dexametasona 6 mg al día durante 10 días o hasta el alta para pacientes no embarazadas gravemente enfermas que reciben oxígeno suplementario o soporte ventilatorio. Los glucocorticoides también pueden tener una función en el tratamiento del choque refractario en pacientes críticamente enfermos con COVID-19 (1).
En gestantes que cumplen los criterios para el uso de glucocorticoides para el tratamiento materno de COVID-19 y también cumplen los criterios para el uso de corticosteroides prenatales para inducir la madurez fetal, se sugiere administrar las dosis habituales de dexametasona (cuatro dosis de 6 mg administrados por vía intramuscular 12 horas de diferencia) o betametasona (dos dosis de 12 mg administradas por vía intramuscular con 24 horas de diferencia) para inducir la maduración pulmonar fetal, seguida de prednisolona (40 mg por vía oral diariamente) o hidrocortisona (80 mg por vía intravenosa dos veces al día) para completar el curso de esteroides maternos. Esto evita exponer al feto a un curso prolongado de dexametasona o betametasona, que atraviesan la placenta de forma metabólicamente activa y así evitar potenciales efectos adversos (5).
Una revisión sobre el tema publicada en marzo de 2021 (6) concluye que la evidencia actual favorece el uso de metilprednisolona frente a prednisolona entre mujeres embarazadas con COVID-19 grave.
Bibliografía
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Last updated: Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Manejo hospitalario de la atención perinatal en gestantes con COVID-19. Adaptación para el SMS. Actualizado a 22 septiembre de 2020. (Ver documento)
- Magala Ssekandi A, Sserwanja Q, Olal E, Kawuki J, Bashir Adam M. Corticosteroids Use in Pregnant Women with COVID-19: Recommendations from Available Evidence. J Multidiscip Healthc. 2021 Mar 16;14:659-663. (Ver documento)
Manejo del parto en la gestante con COVID-19. Última actualización: . Revisión de la literatura: 12/07/2021
Tipo de parto
Respecto a la forma de parto, la decisión de realizar un parto por vía vaginal o de una cesárea debe ser evaluada teniendo en cuenta el criterio obstétrico (1); es decir, el diagnóstico de COVID-19 no es una indicación de parto por cesárea (3).
Y, aunque momento actual no se puede descartar la transmisión durante el parto, se prefiere el parto vaginal en mujeres embarazadas con infección confirmada por COVID-19 para evitar complicaciones quirúrgicas innecesarias; no obstante, un parto por cesárea de emergencia puede ser necesario si está médicamente justificado (por causa materna o fetal). Incluso si la transmisión vertical se confirma a medida que se informan datos adicionales, este hecho no sería una indicación para el parto por cesárea ya que aumentaría el riesgo materno y es poco probable que mejorase el resultado del recién nacido, ya que los informes de infección por COVID-19 en el recién nacido generalmente han descrito una enfermedad leve (2).
En cuanto a este tema, los datos disponibles muestran la tasa de infección no es mayor cuando el bebé nace por vía vaginal: en una revisión sistemática (4), que incluyó 666 recién nacidos de mujeres con COVID-19 confirmado, se confirmó la infección por COVID-19 después del nacimiento en 28 de los 666 (4%) recién nacidos. Al comparar el modo de nacimiento, ocho de 292 (2,7%) recién nacidos nacieron por vía vaginal y 20 de 374 (5,3%) nacieron por cesárea. La tasa de infección tampoco fue mayor cuando el bebé fue amamantado o permaneció con la mujer después del parto.
Otra revisión sistemática publicada en febrero de 2021 (5) encuentra que la tasa de infección neonatal por COVID-19, las muertes neonatales y las muertes maternas no son mayores cuando la madre da a luz por parto vaginal. Concluye que, según los datos disponible, no hay evidencia suficiente que respalde que la cesárea sea mejor que el parto vaginal para prevenir la posible transmisión vertical de una madre embarazada confirmada con COVID-19 a un recién nacido y que el modo de nacimiento debe individualizarse y basarse en la gravedad de la enfermedad y las indicaciones obstétrica.
En un estudio de cohortes multinacional (participaron 43 instituciones de 18 países) (6) se inscribieron un total de 706 mujeres embarazadas con diagnóstico de COVID-19 y 1.424 mujeres embarazadas sin diagnóstico de COVID-19, todas con características demográficas muy similares (edad media 30,2 [6,1] años). Entre las mujeres que dieron positivo (98,1% por RT-PCR), 54 (13%) de sus recién nacidos dieron positivo. El parto por cesárea (RR 2,15; IC del 95%, 1,18-3,91) pero no la lactancia materna (RR 1,10; IC del 95%, 0,66-1,85) se asoció con un mayor riesgo de positividad en la prueba neonatal.
Manejo intraparto
A las mujeres con COVID-19 sintomático confirmado o sospechado se les debería ofrecer monitorización electrónica continua del feto durante el trabajo de parto (1,2).
Como analgesia para el dolor del trabajo de parto se aconseja la analgesia neuroaxial (epidural o combinada) de forma precoz, para evitar cualquier posibilidad de cesárea con anestesia general. No hay evidencia de que la analgesia o la anestesia epidural o espinal estén contraindicadas en presencia de coronavirus (7,8) y se aconseja su uso de forma precoz, para que en caso de que se requiera una cesárea de emergencia, se evite la necesidad de anestesia general (1,2). Sin embargo, si una mujer embarazada está significativamente enferma con dificultad respiratoria o compromiso cardiovascular, entonces la anestesia regional no es apropiada (7).
No se recomienda el uso de técnicas de analgesia inhalatoria por el elevado riesgo de generación de aerosoles y diseminación aérea del virus (1).
El pinzamiento tardío del cordón y el contacto precoz piel con piel son procedimientos recomendables, salvo que la situación clínica de la madre lo desaconseje (8,9).
Se recomienda el manejo activo de la tercera etapa del trabajo de parto (7).
En caso de parto por cesárea se aconseja tomar muestra de líquido peritoneal. Además, dado que existe evidencia de presencia del virus en el líquido peritoneal, se aconseja acortar el tiempo y minimizar el contacto entre el feto y la sangre materna y sus fluidos corporales durante la cesárea (1).
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Berghella V, Hughes B. Coronavirus disease 2019 (COVID-19): Labor, delivery, and postpartum issues and care. This topic last updated: Mar 01, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, Thornton JG. Maternal transmission of SARS-COV-2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG. 2020 Oct;127(11):1324-1336. (Ver documento)
- Cai J, Tang M, Gao Y, Zhang H, Yang Y, Zhang D, Wang H, Liang H, Zhang R, Wu B. Cesarean Section or Vaginal Delivery to Prevent Possible Vertical Transmission From a Pregnant Mother Confirmed With COVID-19 to a Neonate: A Systematic Review. Front Med (Lausanne). 2021 Feb 17;8:634949. (Ver documento)
- Villar J, Ariff S, Gunier RB, Thiruvengadam R, Rauch S, Kholin A, Roggero P, Prefumo F, do Vale MS, Cardona-Perez JA, Maiz N, Cetin I, Savasi V, Deruelle P, Easter SR, Sichitiu J, Soto Conti CP, Ernawati E, Mhatre M, Teji JS, Liu B, Capelli C, Oberto M, Salazar L, Gravett MG, Cavoretto PI, Nachinab VB, Galadanci H, Oros D, Ayede AI, Sentilhes L, Bako B, Savorani M, Cena H, García-May PK, Etuk S, Casale R, Abd-Elsalam S, Ikenoue S, Aminu MB, Vecciarelli C, Duro EA, Usman MA, John-Akinola Y, Nieto R, Ferrazi E, Bhutta ZA, Langer A, Kennedy SH, Papageorghiou AT. Maternal and Neonatal Morbidity and Mortality Among Pregnant Women With and Without COVID-19 Infection: The INTERCOVID Multinational Cohort Study. JAMA Pediatr. 2021 Apr 22. (Ver documento)
- Scottish Intercollegiate Guideline Network. COVID-19 position statement: maternal critical care provision. Nov 2020 [internet publication]. (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- Committee Opinion No. 400: COVID-19 and Pregnancy. Society of Obstetricians and Gynaecologists of Canada. Original: March 13, 2020. Reaffirmed February 15, 2021. (Ver documento)
Lactancia materna. ¿Hay evidencia de la transmisión de la infección a través de la leche materna? Última actualización: . Revisión de la literatura:
La posición unánime es que, aun no estando totalmente clara la posible transmisión del SARS-CoV-2 a través de la leche materna, se considera que los beneficios que la lactancia materna otorga superan los potenciales riesgos. Por elloal, en el caso de mujeres con sospecha o confirmación de COVID-19 se recomienda el amamantamiento desde el nacimiento, siempre que las condiciones clínicas del recién nacido y su madre así lo permitan, y siempre y cuando se mantengan medidas para la prevención de infección por microorganismos transmitidos por gotas y por contacto (1-7) (por ejemplo mediante la higiene de manos asidua y el uso de una mascarilla facial durante el amamantamiento).
Para los CDC la evidencia actual sugiere que la leche materna no es una fuente probable de transmisión del SARS-C0V-2 (8).
En caso de madres de recién nacidos prematuros están precisarán de ayuda para iniciar la extracción de leche en las primeras 2 horas tras el parto para favorecer la administración de calostro a su recién nacido. Mientras ello no sea posible se recomienda la administración de leche humana donada de banco (1,8). Hay datos que sugieren que la pasteurización inactiva el SARS-CoV-2 en la leche materna de donantes; por lo tanto, es muy poco probable que la leche materna pasteurizada de donante sea una fuente de infección por SARS-CoV-2.
En situaciones en las que la gravedad de la enfermedad de la madre (o la situación clínica del bebé) impide continuar con la lactancia materna directa, se debe alentar y apoyar a las madres para que se extraigan la leche, y se proporcione la leche materna de manera segura al lactante (los CDC (8) indican sea preferiblemente un cuidador sano que esté completamente vacunado contra COVID-19 y que no tenga un mayor riesgo de enfermedad grave por COVID-19 el que alimente al niño con la leche materna extraída). En el caso de que la situación de la madre impida la extracción de la leche materna, valorar otras posibilidades como la alimentación con leche materna de donante (7).
Para los casos de madres lactantes fuera del periodo postnatal inmediato y que se infectan por el SARS-CoV-2 se recomienda extremar las medidas de aislamiento (higiene de manos y mascarilla) y seguir amamantando al lactante, o bien hacer una extracción de la leche tomando las máximas precauciones de aislamiento (higiene de manos y mascarilla) y que ésta sea administrada al bebé por un cuidador sano. En estos casos, no es preciso pasteurizar la leche extraída antes de administrarla al bebé (1).
En cuanto al riesgo de transmisión del SARS-CoV-2 a través de la leche materna, una "Living systematic review"(9) que valora la posible transmisión a través de la leche materna incluye, por el momento, 37 estudios en los que se analizan 68 muestras de leche materna de las que 9 dieron positivo al ARN del SARS-CoV-2 mediante análisis de RT-PCR. De los seis niños expuestos a muestras positivas de leche materna, dos recién nacidos dieron negativo para el ARN viral, y tres recién nacidos y un lactante fueron positivos para la infección por SARS-CoV-2 mediante RT-PCR. Los autores de la revisión consideran que, en el momento actual, no se puede asegurar si la transmisión del SARS-CoV-2 a través de la leche materna es posible, ya que la certeza de la evidencia se ha evaluado como muy baja. Además, no se puede descartar la posible transmisión a través de otros fluidos corporales relacionados con la lactancia (como sangre, sudor, gotitas respiratorias o transmisión de gotitas debido al contacto cercano con el lactante o niño pequeño a través de la exposición de piel a piel) o la transmisión aérea.
[Ver información adicional sobre la seguridad de la lactancia materna en Preevid ]
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Berghella V, Hughes B. Coronavirus disease 2019 (COVID-19): Labor, delivery, and postpartum issues and care. This topic last updated: Mar 01, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, Thornton JG. Maternal transmission of SARS-COV-2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG. 2020 Oct;127(11):1324-1336. (Ver documento)
- Scottish Intercollegiate Guideline Network. COVID-19 position statement: maternal critical care provision. Nov 2020 [internet publication]. (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- World Health Organization. COVID-19 Clinical management. Living guidance. 25 January 2021. Geneva: World Health Organization; 2021. (Ver documento)
- CDC: Care for Breastfeeding Women. Interim Guidance on Breastfeeding and Breast Milk Feeds in the Context of COVID-19. Updated June 17, 2021. (Ver documento)
- Centeno-Tablante E, Medina-Rivera M, Finkelstein JL, Rayco-Solon P, Garcia-Casal MN, Rogers L, Ghezzi-Kopel K, Ridwan P, Peña-Rosas JP, Mehta S. Transmission of SARS-CoV-2 through breast milk and breastfeeding: a living systematic review. Ann N Y Acad Sci. 2021 Jan;1484(1):32-54. (Ver documento)
Manejo específico de la infección por SARS-CoV-2 en la mujer gestante. Última actualización: . Revisión de la literatura:
Dado el riesgo potencial de complicación de la infección por SARS-CoV-2 en las mujeres embarazadas, se ha de garantizar la optimización del estado de salud de la madre y el feto con un estrecho seguimiento. Los principios del tratamiento de la embarazada, al igual que el resto de la población, incluyen (1,2):
- medidas de aislamiento precoz
- control de la infección
- toma de muestras para el diagnóstico de COVID-19 y otros virus respiratorios
- oxigenoterapia si es necesario
- evitar la sobrecarga de fluidos
- terapia antibiótica empírica si se sospecha coinfección bacteriana
- monitorización de la dinámica uterina y el bienestar fetal
- ventilación mecánica precoz en caso de deterioro de la función respiratoria
- individualizar el momento más adecuado del parto.
El manejo de la mujer embarazada infectada por SARS-CoV-2 debe correr a cargo de un equipo multidisciplinar que establezca el lugar más adecuado para el correcto tratamiento del binomio madre-feto y que permita mantener el control y la pronta actuación en caso de deterioro materno o fetal o inicio trabajo de parto prematuro. Los cambios en el bienestar fetal pueden ser un primer síntoma de deterioro materno. Basándonos en la experiencia adquirida en esta pandemia, las embarazadas pueden tener un fallo respiratorio severo y en los casos más graves, la ventilación mecánica puede no ser suficiente para conseguir una adecuada oxigenación. En estos casos, se podría plantear la utilización de oxigenación por membrana extracorpórea (el ECMO por sus siglas en inglés).
Se describen como criterios de ingreso o de gravedad en relación al embarazo (2):
- Fiebre persistente ¿ 38 º C a pesar de paracetamol.
- Radiografía de tórax con infiltrados pulmonares u otras imágenes sugestivas de neumonía.
- Gestante con comorbilidades: Hipertensión crónica, Preeclampsia, Diabetes pregestacional, tratamiento inmunosupresor¿.
- Dificultad respiratoria grave: Taquipnea o incremento de la frecuencia respiratoria, ¿ 30 respiraciones por minuto, con:
- Incapacidad para completar frases relativamente cortas (falta de aliento).
- Uso de musculatura accesoria (tiraje intercostal, sub o supraclavicular).
- Sensación de asfixia.
- Saturación de oxígeno por pulsioximetría <95%, respirando aire ambiente.
- Agotamiento respiratorio.
- Patrón respiratorio anormal, como la alternancia de respiraciones rápidas y lentas o pausas largas entre respiraciones.
- Evidencia de deshidratación clínica grave o shock.
- Alteración del nivel de consciencia: confusión, agitación o convulsiones.
- Otros factores considerados por el profesional sanitario responsable del caso: enfermedad rápidamente progresiva o inusualmente prolongada.
Se debería valorar el ingreso en UCI en el caso de una gestante que requiere ¿40% de oxígeno por máscara facial para mantener las saturaciones de oxígeno> 94%(3).
En cuanto a las opciones farmacológicas a utilizar destacar que actualmente no existe un tratamiento específico frente al SARS-CoV-2 y, además, la mayoría de los ensayos clínicos realizados hasta la fecha han excluido a las mujeres embarazadas. Sin embargo, los tratamientos que han mostrado ser potencialmente efectivos no se deberían negar a las mujeres embarazadas en base a la preocupación teórica sobre la seguridad de estos agentes terapéuticos durante el embarazo (4,5). Se ha de tener en cuenta, no obstante, que:
- En el caso de las mujeres embarazadas en estado grave o crítico, el uso de esteroides supera los riesgos y se recomienda su uso. Dado que la dexametasona atraviesa la placenta durante el embarazo se recomienda prednisolona 40 mg por vía oral una vez al día y, en mujeres que no pueden tomar medicamentos por vía oral, 80 mg de hidrocortisona por vía intravenosa dos veces al día en lugar del tratamiento con dexametasona (3-7).
- Entre los casos en los que no se debe administrar remdesivir se incluyen las mujeres embarazadas, lactantes o con test positivo de embarazo: no hay datos o éstos son limitados relativos al uso de remdesivir en mujeres embarazadas por lo que no se debería utilizar a menos que el estado clínico de las mujeres requiera tratamiento con este; se desconoce si remdesivir se excreta en la leche materna o los efectos sobre el lactante o sobre la producción de leche (8).
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Manejo hospitalario de la atención perinatal en gestantes con COVID-19. Adaptación para el SMS. Actualizado a 22 septiembre de 2020. (Ver documento)
- Scottish Intercollegiate Guideline Network. COVID-19 position statement: maternal critical care provision. Nov 2020 [internet publication]. (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Available at https://www.covid19treatmentguidelines.nih.gov/. (Consultado el 12 julio 2021). (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 12 julio 2021) (Ver documento)
- Protocolo farmacoclínico del uso de remdesivir (Veklury®) en el tratamiento de la enfermedad por COVID-19 en el Sistema Nacional de Salud . Ministerio de Sanidad, 08/09/2020. (Ver documento)
¿Está indicada la profilaxis de enfermedad trombótico-venosa (ETV) en el embarazo y puerperio durante la pandemia COVID-19? Última actualización: . Revisión de la literatura:
Las pacientes embarazadas presentan un mayor riesgo trombótico que la población general; además, en el momento actual quedan patentes las alteraciones de la coagulación que sufren las personas que ingresan con COVID-19. En base a este riesgo, en el contexto de la pandemia COVID-19, debería administrarse un tratamiento profiláctico a todas las embarazadas con diagnóstico de COVID-19 confirmado. Asimismo, ante la aparición o una agravación brusca de la disnea, es recomendable sospechar un evento trombótico, diagnosticarlo y tratarlo (1).
En una revisión sistemática (2), con objetivo de evaluar la tasa de trombosis arterial o venosa y la tasa de coagulopatía adquirida en mujeres embarazadas con sospecha de COVID-19 o COVID-19 confirmado, concluye que las complicaciones hematológicas se observan con mayor frecuencia en mujeres embarazadas con infección por COVID-19 (1,26%) que en mujeres embarazadas sin la infección (0,45%). Para los autores estos datos respaldan la recomendación de que todas las mujeres embarazadas ingresadas con sospecha de COVID-19 o COVID-19 confirmado reciban heparina profiláctica de bajo peso molecular (HBPM), a menos que se espere el parto en las próximas de las 12 h, y la continúen con esto durante 10 días después del alta (ver más abajo).
La Sociedad Española de Trombosis y Hemostasia (SETH) (3) ha realizado unas recomendaciones sobre profilaxis de enfermedad tromboembólica venosa (ETV) en el embarazo y puerperio durante la pandemia COVID-19, resumidas en las siguientes tablas:
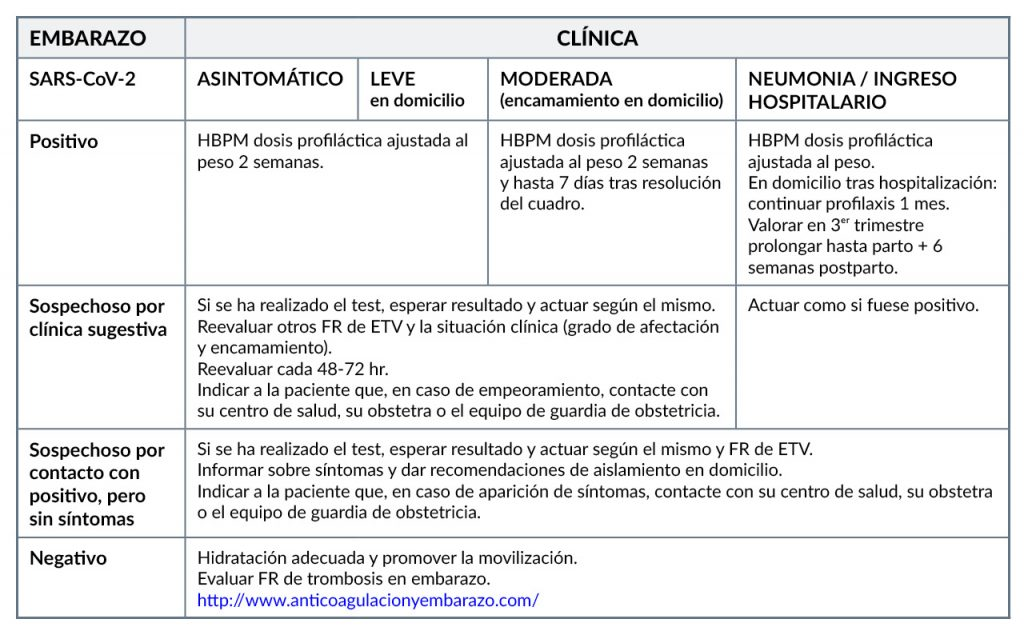
FR: factor de riesgo (se pueden consultar en el texto completo del documento)
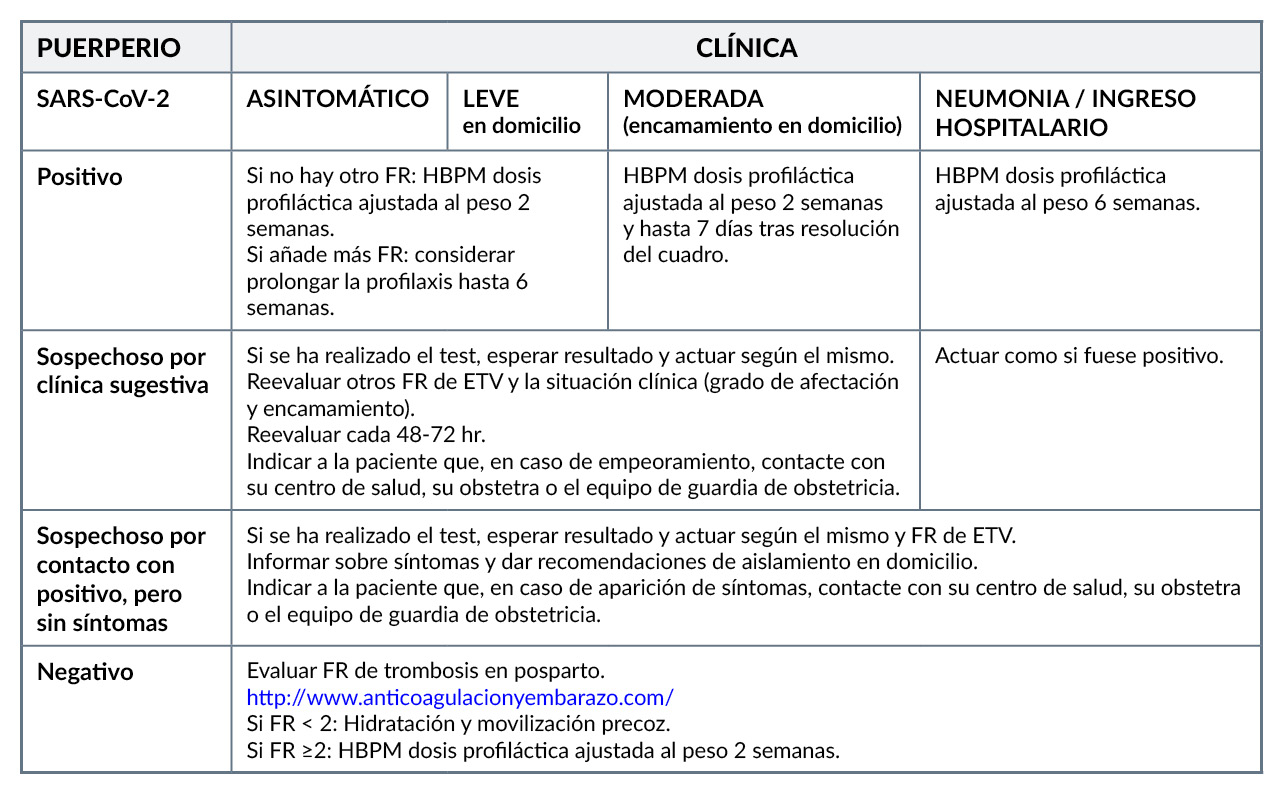
FR: factor de riesgo (se pueden consultar en el texto completo del documento)
La información de las dos tablas anteriores puede encontrarse en Recomendaciones sobre el embarazo y el puerperio de la Sociedad Española de Trombosis y Hemostasis.
Fuera de nuestro contexto sanitario encontramos similares recomendaciones (4,5):
- Se recomienda tromboprofilaxis en mujeres gestantes que se auto-aislan en casa con síntomas leves a moderados de COVID-19 o por sospecha de COVID-19, si tras una valoración individualizada se considera que tienen un riesgo elevado de TEV; se iniciaría profilaxis con HBPM. Continuar con la tromboprofilaxis hasta que las gestantes se hayan recuperado de la enfermedad aguda (entre 7 y 14 días).
- De igual forma, después del parto, se debería evaluar el riesgo de TEV de las mujeres con sospecha o confirmación de COVID-19. La primera dosis de HBPM debería administrarse lo antes posible después del nacimiento, siempre que no haya hemorragia posparto y no se haya utilizado analgesia regional (cuando se ha utilizado analgesia regional, la HBPM puede administrarse 4 horas después de la última inyección espinal o la extracción del catéter epidural).
- Todas las mujeres embarazadas ingresadas con infección por COVID-19 (o sospecha de infección por COVID-19) deberían recibir HBPM profiláctica (a menos que se espere que ocurra el parto dentro de las siguientes 12 horas o exista un riesgo significativo de hemorragia).
- En el caso de una mujer gestante que ha precisado hospitalización por infección confirmada con COVID-19, tras el alta hospitalaria se le debería prescribir HBPM profiláctica al menos 10 días. Considerar una mayor duración de la tromboprofilaxis para mujeres con morbilidad persistente.
- Si las mujeres ingresan con COVID-19 confirmado o sospechado dentro de las 6 semanas posteriores al parto, se les debe ofrecer tromboprofilaxis durante el tiempo que dure su ingreso y durante al menos 10 días después del alta. Considerar extender la tromboprofilaxis hasta las 6 semanas después del parto para mujeres con morbilidad significativa continua.
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Servante J, Swallow G, Thornton JG, Myers B, Munireddy S, Malinowski AK, Othman M, Li W, O'Donoghue K, Walker KF. Haemostatic and thrombo-embolic complications in pregnant women with COVID-19: a systematic review and critical analysis. BMC Pregnancy Childbirth. 2021 Feb 5;21(1):108. (Ver documento)
- Recomendaciones sobre profilaxis ETV en embarazo y puerperio durante la pandemia COVID-19. Sociedad Española de Trombosis y Hemostasia. Fecha de publicación: 16 de abril de 2020. (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
Manejo del neonato hijo de mujeres con COVID-19. Última actualización: . Revisión de la literatura:
En el parto, e inmediatamente después, se recomienda mantener las medidas habituales de cuidado neonatal óptimo (clampaje tardío del cordón, contacto piel con piel inmediato y animar a la primera toma de pecho en la primera hora), salvo en aquellos casos en que lo impidan el estado clínico de la madre o del recién nacido o no se pueda asegurar un adecuado aislamiento madre-hijo.
En madres con COVID-19 confirmada, se tomarán muestras virológicas al recién nacido y dependiendo de este resultado se clasificará al recién nacido como caso confirmado o caso descartado; además debe realizarse una monitorización adecuada, manteniendo un alto índice de sospecha de signos de sepsis / deterioro del bebé.
Con los datos disponibles las infecciones asintomáticas en el periodo neonatal son más frecuentes que las infecciones con síntomas. En los recién nacidos con COVID-19 confirmada que desarrollan síntomas, estos suelen ser leves. Los más frecuentemente descritos son los síntomas respiratorios (taquipnea o rinitis), la fiebre y las dificultades para la alimentación.
Aunque como se ha comentado la enfermedad suele ser leve, se han notificado casos graves de septicemia neonatal y encefalitis de aparición tardía.
En el momento actual, se aconseja, si la situación clínica del neonato y/o la madre lo permiten, el alojamiento conjunto pues la separación entre el recién nacido y la madre puede tener un efecto adverso en la relación entre la madre y el niño y puede perturbar la lactancia materna, cuya importancia es indiscutible.
Para prevenir infecciones por contacto y por gotas entre madre e hijo se recomendará lavado e higiene de manos siempre antes de coger al bebé, mascarilla y cuna separada a 2 m de la cama de la madre y se recomendará que un acompañante sano realice otras tareas de cuidado del neonato. Y se animará y ayudará a las madres a amamantar a demanda; se puede recomendar a las madres el uso de una bata que cubra su ropa y que sea retirada para amamantar, lo que disminuirá el riesgo de transmisión por la ropa.
La duración de la estancia hospitalaria dependerá de los resultados virológicos y las recomendaciones del servicio de vigilancia epidemiológica del hospital, así como del estado clínico y de la situación sociofamiliar. Según estas premisas, tanto en los neonatos COVID-19 positivos como negativos, si se mantienen asintomáticos, es aceptable el alta a partir de las 48 horas de vida llevando a cabo un aislamiento domiciliario y un seguimiento telefónico estrecho.
Los neonatos sintomáticos deben ser ingresados en Neonatología y manejados según protocolo. El alta del recién nacido con infección sintomática COVID-19 se realizará:
- En casos leves: ausencia de fiebre en los 3 días previos, mejoría clínica y RT-PCR negativa en exudado nasofaríngeo.
- En casos graves: ausencia de fiebre en los 3 días previos, mejoría clínica y de la radiografía pulmonar y dos controles de RT-PCR (vía aérea superior e inferior) negativa.
Tras el alta se recomienda realizar un seguimiento clínico (que puede ser no presencial) durante un periodo de tiempo aproximado de dos semanas.
Bibliografía
- Documento técnico: Manejo de la mujer embarazada y el recién nacido con COVID-19. Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Versión de 17 junio de 2020.(Ver documento)
- Berghella V, Hughes B. Coronavirus disease 2019 (COVID-19): Labor, delivery, and postpartum issues and care. This topic last updated: Mar 01, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 08 julio 2021) (Ver documento)
- BMJ Best Practice: Coronavirus disease 2019 (COVID-19). Jul 08, 2021. (Consultado el 12 julio 2021) (Ver documento)
- BMJ Best Practice: Management of coexisting conditions in the context of COVID-19. Last updated: Jul 01, 2021 (Consultado el 12 julio 2021) (Ver documento)
- Royal College of Midwives and Royal College of Obstetricians and Gynaecologists. Coronavirus (COVID-19) infection and pregnancy. Feb 2021 [internet publication].(Ver documento)
- CDC: Evaluation and Management Considerations for Neonates At Risk for COVID-19. Updated Dec. 8, 2020. (Ver documento)
- Committee Opinion No. 400: COVID-19 and Pregnancy. Society of Obstetricians and Gynaecologists of Canada. Original: March 13, 2020. Reaffirmed February 15, 2021. (Ver documento)
- American Academy of Pediatrics. FAQs: management of infants born to mothers with suspected or confirmed COVID-19. Feb 2021 [internet publication]. (Ver documento)
- COVID-19 en Pediatría: valoración crítica de la evidencia. Comité/Grupo de Pediatría Basada en la Evidencia de la AEP y AEPap, 31 de marzo de 2021. (Ver documento)
Vacunación en la mujer embarazada y durante la lactancia. Última actualización: . Revisión de la literatura:
El 17 de abril de 2021 el Joint Committee on Vaccination and Immunisation (JCVI) publicó una nota informativa (ver documento) en la cual establece que a las mujeres embarazadas se les debería ofrecer la vacunación frente a COVID-19 (preferiblemente una vacuna de ARNm) al mismo tiempo que el resto de la población, según su edad y grupo de riesgo clínico. Sin embargo, el JCVI reconoce que se necesita más investigación y aconseja a las mujeres embarazadas que analicen los riesgos y beneficios con su médico.
También se recomienda la vacunación en gestantes y mujeres lactantes en la la guía provisional de los Centers for Disease Control and Prevention (CDC) (1) (con cualquiera de las vacunas autorizadas: Moderna, Pfizer-BioNTech, o J&J/Janssen; aunque se matiza que en personas embarazadas, lactantes y mujeres en posparto menores de 50 años se debería tener en cuenta del riesgo poco común de trombosis asociada a trombocitopenia después de recibir la vacuna Janssen COVID-19). En cuanto al tipo de vacuna, los autores del sumario de evidencia de Uptodate sobre manejo prenatal consideran preferible una vacuna de ARNm pero añaden que si estas no están disponibles, se aconseja utilizar otra de las vacunas autorizadas en lugar de evitar / aplazar la vacunación (2).
La octava actualización de la estrategia de vacunación frente a la COVID-19 del Ministerio de Sanidad (3), publicada en 22 de junio, recuerda que en la actualización 7 de la Estrategia "se acordó recomendar la vacunación a las mujeres embarazadas o en periodo de lactancia con vacunas de ARNm cuando les corresponda según el grupo de priorización al que pertenezcan. Esta recomendación se realiza tras haberse publicado una revisión de los datos disponibles sobre seguridad de la vacunación en el registro de EEUU V-Safe Surveillance correspondientes a 35.691 embarazadas que recibieron vacunas de ARNm. Los datos preliminares del seguimiento de 3.958 participantes del registro V-Safe, de las cuales 827 habían completado el embarazo, muestran que no se han encontrado problemas de seguridad relevantes".
Con respecto al momento más oportuno para su vacunación, se indica que aún no se dispone de información que relacione el momento idóneo de vacunación de la embarazada y la mayor protección conferida al recién nacido.
Esta información se recoge en una de las preguntas del banco de preguntas y respuestas sobre la vacunación frente a la COVID-19 del Ministerio de Sanidad (4). Concretamente a la pregunta de si "¿Puedo vacunarme si estoy embarazada o quiero quedarme embarazada? ¿Y si tengo un bebé lactante?" se contesta que "En base a los datos disponibles -que no indican ningún efecto adverso sobre el embarazo- y las recomendaciones de otros países, se propone vacunar a las embarazadas o mujeres en periodo de lactancia con vacunas de ARNm cuando les corresponda según el grupo de priorización al que pertenezcan y en cualquier momento del embarazo".
En junio de 2021 la Sociedad Española de ginecología y Obstetricia y la Federación de Asociaciones Científico Médicas Españolas (FACME) han elaborado un informe de posicionamiento en el cual sugieren ofrecer la vacunación del COVID-19 a las gestantes a partir de la semana 20 de gestación y preferiblemente con las vacunas de ARNm (5)
Además sugerimos la consulta los posicionamientos de la "Society of Obstetricians and Gynaecologists of Canada" (SCOG) (6) o el "American College of Obstetricians and Gynecologists" (ACOG) (7) y del documento técnico de la OMS (8) sobre la vacunación en gestantes y mujeres lactantes.
En cuanto a la vacunación durante la lactancia materna, en el Banco de Preevid se incluyen dos preguntas que resumen la evidencia disponible (9,10).
Sobre la efectividad (y seguridad) de las vacunas en esta población , destacar que en la web de la Asociación Española de Vacunología se publicó el 16 de marzo de 2021 un resumen de los resultados de un estudio israelí (10) que encuentra que la vacuna de ARNm frente al SARS-CoV-2 administrada durante el embarazo (20 gestantes; tercer trimestre del embarazo) indujo una respuesta serológica materna adecuada con una transferencia transplacentaria posterior eficiente. Comenta el autor de la sinopsis que aunque los resultados son alentadores todavía quedan varias preguntas para las que todavía no se dispone de respuesta; entre ellas el momento óptimo de la vacunación de la embarazada y la duración de los anticuerpos pasivos y el papel de la lactancia materna para mantener la inmunidad neonatal. Además, considera que "hacen falta estudios con más población para evaluar con mayor profundidad la eficacia y la seguridad de las diferentes vacunas durante el embarazo".
En esta web también encontramos referencia a un estudio de cohortes publicado en marzo de 2021 (11) pone de manifiesto que las respuestas inmunes tras la recepción de dos dosis de vacuna (recibidas en el tercer trimestre) eran equivalentes para las embarazadas (n=84) y las que lactaban (n=31) en relación a las no embarazadas (n=16) y que los títulos de anticuerpos frente a la glicoproteína S y frente al Receptor Binding Domain eran mayores que los originados por la infección COVID-19 durante el embarazo (controles). El perfil de efectos adversos postvacunales fue similar al de las no embarazadas, aunque el 32% de las vacunadas durante el embarazo tuvieron fiebre tras la segunda dosis.
Otro estudio de cohortes israelí encuentra una fuerte secreción de anticuerpos IgA e IgG específicos del SARS-CoV-2 en la leche materna 6 semanas después de la vacunación (84 mujeres lactantes completaron el estudio, proporcionando 504 muestras de leche materna; todas las mujeres recibieron 2 dosis de la vacuna Pfizer-BioNTech) (12).
Bibliografía
- Centers for Disease Control and Prevention: Interim Clinical Considerations for Use of COVID-19 Vaccines Currently Authorized in the United States. Last updated July 2, 2021. (Ver documento)
- Berghella V. Coronavirus disease 2019 (COVID-19): Pregnancy issues and antenatal care. This topic last updated: May 14, 2021. Lockwood CJ, ed. UpToDate. Waltham, MA: UpToDate Inc. (Consultado el 13 julio 2021) (Ver documento)
- Actualización 8: Estrategia de vacunación frente a COVID19 en España. Grupo de Trabajo Técnico de Vacunación COVID-19, de la Ponencia de Programa y Registro de Vacunaciones. 22 junio de 2021 . (Ver documento)
- Preguntas y respuestas: ¿Puedo vacunarme si estoy embarazada o quiero quedarme embarazada? ¿Y si tengo un bebé lactante?. Estrategia de vacunación COVID-19. Gobierno de España. Actualización: 6/7/2021. (Ver documento)
- Recomendaciones FACME para la vacunación frente a COVID-19 en mujeres embarazadas. Fecha de la recomendación: 20 de junio de 2021. (Ver documento)
- SOGC Statement on COVID-19 Vaccination in Pregnancy Version date: December 18 th, 2020. Reaffirmed date: May 25, 2021. (Ver documento)
- Vaccinating Pregnant and Lactating Patients Against COVID-19. American College of Obstetricians and Gynecologists. Last updated July 2, 2021. (Ver documento)
- Technical document: Update on WHO Interim recommendations on COVID-19 vaccination of pregnant and lactating women; 10 June 2021. (Ver documento)
- Banco de Preguntas Preevid. Vacuna COVID-19 y lactancia materna. Murciasalud, 2021. (Ver documento)
- Banco de Preguntas Preevid. Vacuna COVID-19 y lactancia materna. V2. Murciasalud, 2021. (Ver documento)
- Rottenstreich A, Zarbiv G, Oiknine-Djian E, Zigron R, Wolf DG, Porat S. Efficient maternofetal transplacental transfer of anti- SARS-CoV-2 spike antibodies after antenatal SARS-CoV-2 BNT162b2 mRNA vaccination. Clin Infect Dis. 2021 Apr 3:ciab266. (Ver documento)
- Gray KJ, Bordt EA, Atyeo C, Deriso E, Akinwunmi B, Young N, Medina Baez A, Shook LL, Cvrk D, James K, De Guzman R, Brigida S, Diouf K, Goldfarb I, Bebell LM, Yonker LM, Fasano A, Rabi SA, Elovitz MA, Alter G, Edlow AG. COVID-19 vaccine response in pregnant and lactating women: a cohort study. Am J Obstet Gynecol. 2021 Mar 24:S0002-9378(21)00187-3. (Ver documento)
- Perl SH, Uzan-Yulzari A, Klainer H, Asiskovich L, Youngster M, Rinott E, Youngster I. SARS-CoV-2-Specific Antibodies in Breast Milk After COVID-19 Vaccination of Breastfeeding Women. JAMA. 2021 Apr 12. (Ver documento)
Información adicional
Revisión bibliográfica realizada con el objetivo de desarrollar una base de datos de guías de práctica clínica nacionales e internacionales relacionadas con la atención prenatal, intraparto y posparto de las mujeres durante la pandemia de COVID-19 e identificar aquellas intervenciones en las que había un alto y bajo consenso entre las recomendaciones (1).
Documento técnico del Servicio Murciano de Salud sobre la atención al embarazo, lactancia y puerperio en Atención Primaria, durante la pandemia de la COVID-19 (2). Describe el documento el control y seguimiento del embarazo normal y el manejo de la lactancia y el puerperio.
Puede ampliar la información en cuanto al manejo de la mujer gestante en el contexto de la pandemia por COVID-19, en el banco de preguntas elaborado por el "American College of Obstetricians and Gynecologists" (3).
- Pavlidis P, Eddy K, Phung L, Farrington E, Connolly M, Lopes R, Wilson AN, Homer CSE, Vogel JP. Clinical guidelines for caring for women with COVID-19 during pregnancy, childbirth and the immediate postpartum period. Women Birth. 2020 Nov 3:S1871-5192(20)30372-3. (Ver documento)
- Atención al embarazo, lactancia y puerperio durante la pandemia del COVID-19. Adaptación para el SMS del PIAM 2012. Servicio Murciano de Salud. Actualizado a 13 de noviembre de 2020. (Ver documento)
- American College of Obstetricians and Gynecologists. COVID-19 FAQs for obstetricians-gynecologists, obstetrics. Washington, DC: ACOG; 2020. (Ver documento)
Advertencia
La información de esta Web está dirigida a los profesionales sanitarios. No está diseñada ni redactada para la lectura de la población general o de los pacientes, siendo recomendable, en estos casos, la consulta de la información específica que para los ciudadanos publica el Ministerio de Sanidad del Gobierno de España o la Consejería de Salud de la Región de Murcia
